Introducción.
El objetivo de las máquinas térmicas es convertir calor en trabajo mecánico o llevar calor de una fuente de calor fría a otra más caliente (refirgeración). En esta pçagina se presenta un ejemplo de máquina térmica con el objetivo principal de ilustrar su funcionamiento y los principios que lo rigen, que son las leyes de la termodinámica.
Una máquina térmica muy sencilla.
Estudiaremos una máquina térmica que realiza trabajo mecánico
elevando bloques y lo hace transfiriendo calor de una fuente caliente a una fría.
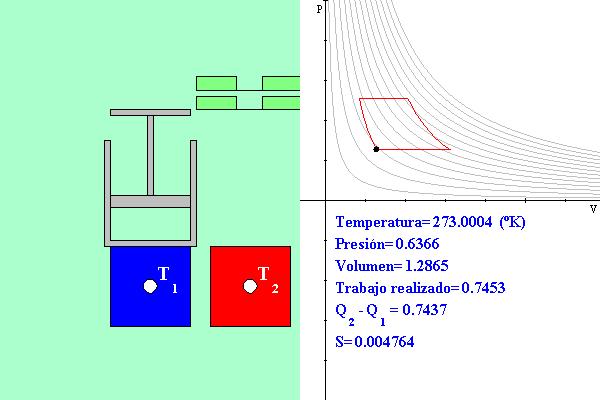 Suponemos que contamos con una fuente de calor fría que se
mantiene siempre a temperatura T1 y es capaz de absorber cualquier cantidad de
calor y otra caliente que se mantiene a temperatura constante T2 > T1
y es capaz de sumunistrar cualquier cantidad de calor. Contamos también con un cilindro y
su pistón que contiene cierta cantidad de un gas ideal y que en cualquier momento podemos
poner en contacto cualquiera de las dos fuentes de calor con el cilindro para así
enfriarlo hasta una temperatura T1 o calentarlo a una temperatura T2.
La presión del gas variará entre dos valores fijos, el menor P1 determinado
por el peso del pistón y el mayor P2 determinado por el peso del pistón más
el de un bloque. La máquina funcionará así:
Suponemos que contamos con una fuente de calor fría que se
mantiene siempre a temperatura T1 y es capaz de absorber cualquier cantidad de
calor y otra caliente que se mantiene a temperatura constante T2 > T1
y es capaz de sumunistrar cualquier cantidad de calor. Contamos también con un cilindro y
su pistón que contiene cierta cantidad de un gas ideal y que en cualquier momento podemos
poner en contacto cualquiera de las dos fuentes de calor con el cilindro para así
enfriarlo hasta una temperatura T1 o calentarlo a una temperatura T2.
La presión del gas variará entre dos valores fijos, el menor P1 determinado
por el peso del pistón y el mayor P2 determinado por el peso del pistón más
el de un bloque. La máquina funcionará así:
1) Compresión adiabática. Cuando el cilindro se encuentra a temperatura T1 el gas está comprimido y el pistón se encuentra abajo. Entonces se montará un bloque de masa m sobre el pistón, lo cual aumentará la presión del gas disminuyendo aún más su volumen y aumentando ligeramente su temperatura. Se supone que el cambio de presión se hace suavemente (algo no indicado en el esquema que va soltando poco a poco la masa). Durante esta etapa no hay intercambio de calor, por eso se llama compresión adiabática. El aumento de temperatura es consecuencia del trabajo realizado por la masa sobre el gas al comprimirlo. Durante esta etapa no cambia la entropía del gas ni la del universo.
2) Expansión por calentamiento. Se acerca la fuente
de calor de temperatura T2 al cilindro, lo cual hará que su temperatura
aumente hasta alcanzar el mismo valor T2. Como la presión es constante, el
volumen del gas aumenta y el pistón sube elevando el pistón y el bloque y aumentando su
energía potencial. Este aumento de energía potencial es igual al trabajo realizado por
el gas sobre el pistón y el bloque, el cual proviene del calor transferido por T2
al gas. No todo ese calor se convierte en trabajo, parte queda como energía interna del
gas y sus manifestaciones físicas son el aumento de temperatura y del volumen del gas. La
parte del trabajo realizado sobre el pistón volverá a convertirse en calor más
adelante, pero el trabajo realizado sobre el bloque se conservará como energía
potencial. Durante esta etapa disminuye la entropía de la fuente T2 y aumenta
la del gas. Esta parte del ciclo no es un proceso reversible: no es posible comprimir el
gas y que éste vaya a la vez enfriándose y tranfiriendo calor a la fuente caliente T2.
Por eso, como en todos los proceso irreversibles, la entropía del universo aumenta. En
efecto, la entropía del gas a temperatura variable T
3) Expansión adiabática. Se retira la fuente de calor a temperatura T2 y se desmonta el bloque de masa m, con lo cual disminuye la presión sobre el gas, su volumen aumenta aún más y disminuye un poco su temperatura. Se supone que algo no ilustrado en la escena va retirando poco a poco la masa haciendo que la disminución de presión sea gradual. La disminución de temperatura se debe a la expansión del gas. Durante este proceso no hay intercambio de calor, por eso es adiabático. No hay cambio en la entropía del gas ni en la del universo.
4) Compresión por enfriamiento. Se acerca la fuente "fría" de calor de temperatura T1 y se pone en contacto con el cilindro. Esto hace que la temperatura del gas disminuya poco a poco hasta alcanzar el valor T1 con lo cual el volumen también disminuya. El pistón baja. El gas del cilindro pierde calor por transferencia a T1. Al bajar el pistón éste realiza trabajo sobre el gas que se convierte en calor que es transferido a T1, es decir, el trabajo realizado sobre el pistón en el paso 2) ahora se recupera en forma de calor, pero el trabajo hecho sobre el bloque en el paso 2) se mantiene en forma de energía potencial. ¿Qué pasa aquí con la entropía? Como hay transferencia de calor del gas (a temperatura variable T > T1, el aumento de entropía en T1 es dQ/T1 > dQ/T , la pérdida de entropía del gas. Otra vez, como en todos los procesos irreversibles, la entropía del universo aumenta.
El ciclo 1) 2) 3) 4) se repite indefinidamente. El resultado es que en cada ciclo la máquina realiza un trabajo mecánico elevando un bloque y transfiriendo calor del la fuente caliente T2 a la fuente fría T1.
La siguiente escena ilustra el funcionamiento de esta máquina y muestra los resultados cuantitativos en cada momento y el rendimiento después de cada ciclo.